近日,北京华龛生物科技有限公司(以下简称华龛生物)战略合作伙伴——广州达博生物制品有限公司(以下简称达博生物)自主研发的Ⅰ类生物制品“人脐带间充质干细胞注射液”的新药临床试验 (IND)申请,获得国家药品监督管理局(CDE)受理,本次申请的适应症为Ⅱ型糖尿病。该干细胞新药采用华龛生物3D FloTrix® 系列产品及工艺,进行细胞规模化三维培养扩增制备,成为首例使用三维全封闭、规模化、自动化生产工艺进行的IND申报受理的干细胞新药。
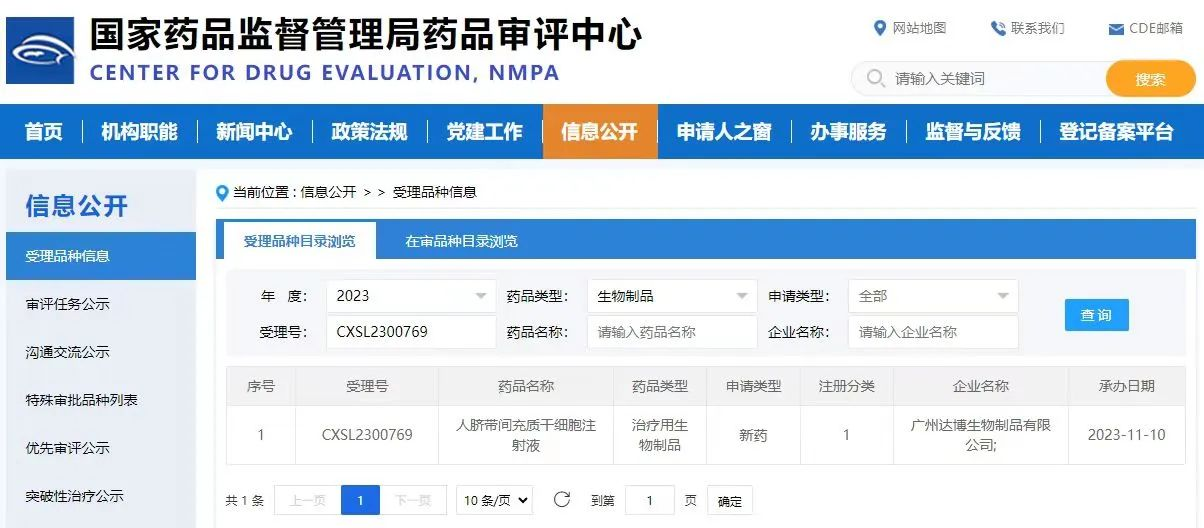
达博生物首次采用华龛生物3D TableTrix® 微载体及裂解液、3D FloTrix® 间充质干细胞无血清培养基及系列自动化设备装置,制备的3D人脐带间充质干细胞用于干细胞新药临床试验申请,为后期临床试验及商业化规模生产奠定了坚实的技术基础。
华龛生物3D全封闭、规模化、自动化工艺制备的干细胞新药获得CDE受理,标志着3D TableTrix® 微载体作为细胞治疗产品生产用原材料,其质量安全、风险可控;经3D FloTrix® 工艺制备的人间充质干细胞产品,其生产工艺稳定性和细胞质量,满足干细胞治疗产品临床应用基本标准,获得监管部门认可。

华龛生物由清华大学医学院杜亚楠教授科研团队领衔创建,清华大学参股共建。核心技术源于清华大学的科技成果转化。公司专注于打造原创3D细胞“智造”平台,提供基于3D微载体的细胞规模化定制化扩增工艺整体解决方案。华龛生物核心产品3D TableTrix®微载片(微载体),是自主创新型、首款可用于细胞药物开发的药用辅料级微载体。已通过中检院等相关权威机构的检验报告,并获得2项国家药监局药用辅料资质(CDE审批登记号:F20210000003、F20200000496),同时获得美国FDA DMF药用辅料资质(DMF:35481)。华龛生物自研产品3D FloTrix® 间充质干细胞无血清培养基,已获得美国FDA DMF备案(DMF:038476)。
华龛生物的产品与服务,可广泛应用于基因与细胞治疗、细胞外囊泡、疫苗及蛋白产品等生产的上游工艺开发。同时,在再生医学、类器官与食品科技(细胞培养肉等)领域也具有广泛应用前景。
公司拥有5000平米的研发与转化平台,其中包括4000平米的GMP生产平台,1000余平的以3D细胞智造及微组织再生医学治疗产品为核心的CDMO服务平台;新建1200L微载体生产线。相关技术已获得100余项专利成果,30余篇国际期刊报道。核心技术项目已获得多项国家级立项支持与应用。


2020年,北京首都科技发展集团旗下北京首发展天玑创业投资中心(有限合伙)参与完成对华龛生物A轮投资。在此期间,首发展为华龛生物提供资金、场地资源,扩大其运营面积,合作构建“3D细胞规模化智造转化应用平台”;并将华龛生物作为亮点项目,多渠道进行推介与宣传,及时推送最新政策信息,提供政策信息相关服务。
版权声明:本文由“北京首都科技发展集团”公众号编辑,来源“华龛生物”。